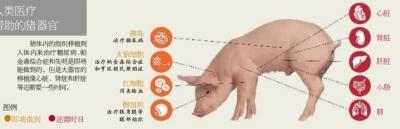

对人类医疗 有帮助的猪器官。制图/方磊
猪体内的组织移植到人体内来治疗糖尿病、帕金森综合症和失明是即将能做到的,但是大器官的移植像心脏、肾脏和肝脏等还需要一些时间。
新华社电 中美研究人员最近在美国《科学》杂志网络版上报告说,他们利用一种新的基因编辑技术,敲除了猪基因组中可能有害的病毒基因,从而扫清猪器官用于人体移植的重大难关,为全世界需要器官移植的上百万病人带来希望。
鉴于这项成果的意义重大,美国《科学》杂志一次性审稿,并提前在线刊登论文,而不是按惯例等到每周的星期四发表。
内源性逆转录病毒是嵌在细胞内基因组的病毒,在猪身体里面不会有毒性。但当猪的细胞和人的细胞接触时,这种病毒会从猪的基因组“跳”到人的基因组中。
异种病毒传播最典型的例子就是艾滋病病毒(一种逆转录病毒)从灵长类动物传播到人类,至今还没有有效彻底的医疗方法防御和清除艾滋病毒。因此,猪基因组的内源性逆转录病毒成为人体移植利用猪器官面临的一个重大医疗风险问题。
据不完全统计,全世界大概有200万人需要器官移植,但是器官捐献的数量远远低于需要的人数。移植器官供体不足随着老龄化和慢性疾病的多发而愈发严重。猪的器官因为大小和功能和人类似,被认为是最有可能成为能移植到人的异种器官。
上世纪90年代,欧美政府花大力气来推动猪器官移植项目,几个全球大药厂也投了巨资希望解决猪器官的人体排斥问题,但没想到后来发现猪的基因组里面有内源性逆转录病毒存在,最终世界卫生组织和美国政府都明令,在找到解决办法之前,停止一切异种器官移植的临床试验。
美国哈佛大学等机构的研究人员利用名为CRISPR-Cas9的基因剪刀技术,敲除了猪基因组中可能的致病基因。
大多数的基因改造都是一个基因层面上的修改,而一个猪细胞内有62个拷贝内源性逆转录病毒基因需要修改。参与研究的杨璐菡等人随后将改造后的猪细胞和人细胞一起培养,发现猪病毒侵染率下降到了以前的千分之一。
科学价值是什么 最大程度杜绝猪源性疾病转移到人
解读
中国人体器官获取组织联盟秘书、中南医院器官移植专家王彦峰对长江日报记者表示:首先避免把动物间传播的疾病,带到人之间传播。
器官移植把猪器官移植到人身上,就可能把猪所患的猪源性疾病传播到人,对人类造成极大危害。而这次研究成果引发轰动,正是在于把可引发猪源性疾病的基因敲除掉。
做基因敲除,即让生物体内某一个基因失活,在上世纪80年代就开始了。最初一次敲除一个,逐渐地一次敲除两个,到敲除三个,非常不容易。这次成果采用了新的方式,一次可敲除几十个基因。这意味可最大程度预防或杜绝猪源性疾病发展到人身上。
实际困难有哪些 疾风暴雨的排斥反应没有解决
但是,本次成果对动物器官移植的排斥反应并没有改善。王彦峰介绍,目前临床上运用的器官移植都是同种异体,不同的人与人之间移植。移植会发生排斥现象,通俗地说,自身的躯体不认可外来的器官。临床上已实现通过成熟的药物解决。移植者往往需要终身服用抗排斥药物。
而动物与人之间是异种,移植会发生非常剧烈的排斥反应,如同疾风暴雨,对人体和器官本身都是致命的,这个问题仍然没有解决。
此外,除了排斥反应,猪和人组织结构虽有同源性,但仍有细小难以逾越的差异。比如猪和人都有的血红蛋白,但存在细小的差异,可就这一点,就会在人体内造成很大障碍。如猪肝移植到人体内,以猪的DNA模板来复制这种蛋白,很可能猪器官到人身上出现功能不全。但研究成果让猪器官移植给人类前进一大步。
目前,动物器官移植到人类,只有极少数的试探性移植,都不能实现长期存活,效果不确切。有猪的心脏瓣膜移植到人,用于治疗心脏的疾病,但这属于失去活性的组织结构,而用于移植的器官,必须是活着的。
为什么是猪器官 与人体器官最接近较易获得
据了解,中国每年30万患者苦等器官移植,而能够实现的移植手术仅为1万余例。在世界范围同样存在器官需求的巨大缺口。
同济医院器官移植研究所所长陈知水教授介绍,全世界的科学家和医学专家们不断探索动物器官移植到人的可能。而在可能移植的动物器官中,首推猪器官,因为猪器官与人体器官最接近,相对容易获得。(记者刘睿彻)
课题带头人杨璐菡:
曾首次利用“基因剪刀”
修改细胞基因组
参与研究的哈佛大学博士后和eGenesis异种器官移植课题带头人杨璐菡告诉记者:“这个工作扫除了10多年前发现猪内源性逆转录病毒后在这个领域的最大的安全障碍,也重新燃起了大家对异种器官移植的信心。”
从2014年起,杨璐菡做为异种器官移植课题带头人,带领10个人的科研团队在哈佛和eGenesis利用新发明的一种叫做CRISPR-Cas9的“基因剪刀”技术,敲除猪基因组中可能的致病基因。
今年29岁的杨璐菡2008年本科毕业于北京大学,曾因第一个利用CRISPR-Cas9技术修改细胞基因组和领导eGenesis,而被福布斯杂志评为2014年30岁以下30个科学医疗领域(30 under 30)领军人物之一。她说,希望在接下来5年时间内,把异种器官移植向临床方向推动。当然,异种器官移植除了技术方面的问题,还有生物伦理问题、商业规范问题等需要解决。
综合新华社等